Impacto del Sueño y la Modalidad de Diálisis sobre la Calidad de Vida en una Población
 Sunday, March 29, 2020 at 8:00AM
Sunday, March 29, 2020 at 8:00AM Editor's Note: The following article was previously published in English in the SWJPCC as SWJPCC 017-19. It is reproduced in Spanish because of its relevance to our Spanish-speaking readers.
Luxana Reynaga-Ornelas, Ph.D., R.N.1
Carol M. Baldwin, Ph.D., R.N., AHN-BC, F.A.A.N.2
Kimberly Arcoleo, Ph.D., M.P.H.3
Stuart F. Quan, M.D.2,4,5
1 División de Ciencias de la Salud. Departamento de Enfermería y Obstetricia Sede León
Universidad de Guanajuato
Sede San Carlos; Blvd. Puente Milenio #1001; Fracción del Predio San Carlos; C.P. 37670; León, Gto, Mexico
2 Arizona State University, Edson College of Nursing and Health Innovation
PAHO/WHO Collaborating Centre to Advance the Policy on Research for Health
500 N. 3rd Street, Phoenix, AZ 85004
3 University of Rochester School of Nursing
Box SON, Helen Wood Hall
601 Elmwood Avenue, Rochester, NY 14642
4 Division of Sleep and Circadian Disorders Brigham and Women’s Hospital and Harvard Medical School
221 Longwood Ave. Boston, MA 02115
5 Asthma and Airway Disease Research Center, University of Arizona College of Medicine
1501 N. Campbell Ave., Tucson, AZ 85725
Resumen
Antecedentes: La calidad de vida relacionada con la salud (CVRS) se encuentra disminuida en la enfermedad renal en etapa avanzada (EREA) pero se conoce poco acerca del impacto de los trastornos del sueño, la modalidad de diálisis y los factores demográficos sobre la CVRS de pacientes mexicanos con EREA.
Métodos: Se incluyeron 121 adultos con EREA pertenecientes a 4 unidades de diálisis del estado de Guanajuato, México, estratificados por unidad y modalidad de diálisis (Hemodiálisis [HD], diálisis peritoneal continua ambulatoria [DPCA] y diálisis peritoneal automatizada [DPA]). Se realizó un análisis de la información clínica y los datos obtenidos del Sleep Hart Health Study Sleep Habits Questionnaire, del cuestionario corto del Medical Outcomes Study (MOS; SF-36) y de la Escala de Somnolencia Epworth.
Resultados: En general, los síntomas y los trastornos del sueño fueron frecuentes (ej. insomnio 37.2%). Los puntajes de SF-36 resultaron más bajos comparados con las normas de México y Estados Unidos. En la subescala de Vitalidad, los pacientes de HD reportaron mejor CVRS y los pacientes de DPCA la peor CVRS. En el modelo de análisis multivariado, la modalidad de diálisis y los trastornos del sueño en grupo y el ingreso bajo, resultaron asociados significativamente con una pobre calidad de vida total (SF-36) y una pobre salud mental (CVRS). Los modelos de calidad de vida total y del componente mental mostraron una CVRS significativamente mejor tanto para DPA como para la HD con tamaños del efecto de pequeño a moderado. El análisis de costo-efectividad mostró ventaja para la DPA.
Conclusiones: Los pacientes mexicanos de EREA tienen una CVRS reducida, y los trastornos del sueño pueden ser importantes para conducir a este hallazgo. La DPA debe ser la modalidad de diálisis de preferencia en México.
Introducción
La prevalencia de la enfermedad renal en etapa avanzada está aumentando en todo el mundo con una prevalencia estimada en 2010 de 4.9 millones de personas. Desafortunadamente, solo la mitad recibe diálisis; esta necesidad se proyecta más del doble para 2030 (1). La enfermedad renal en etapa avanzada está asociada con morbilidad y mortalidad cardiovascular, diabetes tipo 2, deterioro cognitivo, y trastornos minerales y óseos. En México, es un problema de salud significativo con una tasa de prevalencia e incidencia anual de 1,564 y 412 por millón de personas respectivamente, con mas de 65,000 individuos recibiendo diálisis (2). Además, entre el 2000 y el 2013, la tasa de incidencia de EREA ha incrementado 122% (2). Tiene una tasa de mortalidad de 12.3 muertes por 100,000 habitantes y es la segunda causa de años perdidos por muerte prematuras (2). El tratamiento más común para la EREA en México es la hemodiálisis (HD) llevada a cabo en centros de diálisis en más del 50% de los pacientes. Los restantes reciben diálisis peritoneal (DP) en casa, de los cuales 70% están en diálisis peritoneal continua ambulatoria (DPCA) y el 30% están en diálisis peritoneal automatizada (DPA) (2). Con la DPCA, la solución de diálisis se infunde manualmente hacia la cavidad peritoneal y es drenada después de pocas horas usualmente cuatro veces al día. Con la DPA, el proceso es automatizado con un equipo con alarmas y dispositivos de seguridad y es realizada durante la noche. El trasplante renal es poco frecuente.
El tratamiento para la EREA tiene significativas implicaciones fisiológicas y socioeconómicas para el individuo, la familia y la comunidad. No sorprende que las personas con EREA reporten una calidad de vida relacionada con la salud (CVRS) más pobre en comparación con la población general (3,4). Varios estudios han examinado el tipo de modalidad de diálisis y la CVRS. Se han identificado mejores puntajes de CVRS para DP comparado con HD en el tratamiento para la EREA (5,6), pero no siempre (7-9). Un meta análisis encontró una mejor calidad de vida basada en la utilidad para DPA comparado con DPCA (10) y un estudio reciente encontró que la DPA está asociada con una mejor salud física y moderados síntomas relacionados con la diálisis en comparación con la DPCA (11). La mayoría de los estudios incluidos en el meta análisis eran de Norteamérica, Europa o Asia. Existen pocos datos disponibles que comparen la CVRS según la modalidad de diálisis en personas con EREA en países de Latinoamérica incluyendo México.
Los trastornos del sueño en personas con EREA son comunes, con una prevalencia estimada 50 a mas de 80%, e influyen negativamente en la CVRS (12-14). En los pacientes con EREA se incluyen pesadillas, somnolencia excesiva diurna (SED), síndrome de piernas inquietas (SPI), síndrome de apnea del sueño (SAS), insomnio y pobre calidad del sueño (13). No es claro si la prevalencia y la severidad de los trastornos del sueño son similares entre las modalidades de diálisis; estudios previos han reportado resultados contradictorios con tasas equivalentes (15-17) y tasas diferentes (20). Solo un estudio realizó comparaciones entre HD, DPCA y DPA (20). Encontraron tasas similares de insomnio pero menores en SAS con HD, y mayores en SPI con DPA.
El propósito de este estudio fue determinar las asociaciones entre CVRS y los trastornos del sueño en función de la modalidad de diálisis en una población mexicana con EREA. Una asociación diferenciada puede ser un factor importante para la elección de las modalidades de diálisis. Nuestra hipótesis fue que en esta población, los trastornos del sueño serían un determinante importante de la CVRS en EREA, que DPA estaría asociada a una mejor calidad de vida y tendría un mayor costo-efectividad que la HD y la DPCA.
Métodos
Diseño
Se realizó un muestreo por conveniencia de 125 pacientes con EREA seleccionados entre personas aseguradas en el Instituto para la Salud y la Seguridad Social de los Trabajadores del Estado (ISSSTE) quienes vivían en el Estado de Guanajuato, México. Los participantes fueron seleccionados proporcionalmente por clusters. La muestra incluyó 30 pacientes de cada localidad geográfica de las unidades de diálisis de las ciudades de Celaya, Irapuato, Guanajuato y León; diez pacientes fueron seleccionados de cada modalidad (DPCA, DPA, y HD). Los pacientes fueron incluidos si tenían 18 años o más, hablaban español, recibían diálisis y no habían estado hospitalizados dentro de los tres meses previos al reclutamiento. Los pacientes con déficit cognitivo u otros déficits mentales que les impidieran completar los cuestionarios fueron excluidos del estudio. Fueron reclutados para su participación durante su reunión mensual, o bien en la sala de espera de consulta del especialista. En el momento de contacto inicial o con una cita posterior, se solicitaba al paciente que proporcionara el consentimiento informado, y completara de manera individual la entrevista y los cuestionarios que incluían información acerca de su salud, sueño y CVRS. También se les pidió dar un consentimiento para la revisión de sus expedientes. El estudio fue aprobado por el Comité de Ética de la Universidad de Guanajuato y el Consejo Institucional Revisor de Arizona State University.
Recolección de datos
Los entrevistadores capacitados obtuvieron información relacionada con edad, sexo, estado civil, estado socioeconómico (ESE), nivel de educación, número de hospitalizaciones, y tiempo desde el primer tratamiento. Los participantes también completaron la versión en español validada del cuestionario Sleep Heart Health Study Sleep Habits Questionnaire y de la versión corta en español de 36 items del Medical Outcomes Study (MOS) SF-36 para la medición de CVRS. Se registraron su peso y su estatura para determinar el índice de masa corporal (IMC). Del expediente médico de los participantes se recolectaron los datos más recientes de los últimos tres meses de niveles séricos de glucosa, albumina, creatinina, urea, y hematocrito/hemoglobina. Otros datos clínicos adicionales fueron recolectados para calcular el costo financiero como; etiología de la EREA, hospitalizaciones en el último año, tipo de catéter, dosis de diálisis, número de drogas antihipertensivas, uso de eritropoyetina, número de sesiones de HD por semana y tiempo de la última visita domiciliaria realizada por el equipo de salud
Instrumentos de medición
Sleep Heart Health Sleep Study (SHHS), Sleep Habits Questionnaire (SHQ). El instrumento SHQ ha sido utilizado frecuentemente con pacientes con trastornos del sueño no identificados. El cuestionario se enfoca en nueve aspectos de trastornos del sueño: 1) Ronquido; 2) Pausas en la respiración (apnea); 3) Apneas observadas por otros; 4) Somnolencia diurna; 5) Sueño insuficiente; 6) Síntomas de insomnio incluyendo sueño no reparador; 7) Pesadillas; 8) Síndrome de piernas inquietas; y 9) Duración del sueño reportado en días de la semana y fines de semana. Los síntomas de sueño fueron calificados en una escala de 5-puntos tipo Likert desde ‘Nunca’ hasta ‘Casi siempre’. El SHQ se desarrolló para el SHHS, ha sido utilizado en una variedad de investigaciones y es aceptado como un medio apropiado para caracterizar la salud del sueño. La versión en español del SHQ fue validada por Baldwin y colaboradores y muestra concordancia con la versión en inglés (21).
Epworth Sleepiness Scale. El Epworth Sleepiness Scale (ESS) es un instrumento validado de auto-llenado que pide a los sujetos que califiquen la posibilidad de quedarse dormido durante ocho situaciones comunes usando cuatro categorías ordinales que van del 0 (nula posibilidad) a 3 (alta posibilidad) (22). Los puntajes van de 0 al 24 con un puntaje >10 sugiriendo SSD (22). La versión en español del ESS fue incorporada al SHQ y ha demostrado una confiabilidad y validez equivalentes a la versión en inglés (23).
Medical Outcomes Survey (MOS) Versión corta SF-36 (Versión español). El MOS SF-36 es una medición ampliamente utilizada del estado de salud y la calidad de vida (24). Mide las variaciones en las prácticas y resultados del cuidado de la salud en una encuesta auto administrada que evalúa ocho dimensiones de salud. Los puntajes de cada subescala tienen un rango de 0-100, con puntajes más altos representando una mejor calidad de vida (24). Las subescalas miden los siguientes ocho conceptos de salud general: función física (FF), rol físico (RF), dolor corporal (DC), salud general (SG), vitalidad (VT), función social (FS), salud mental (SM) y rol emocional (RE). La versión en español fue validada en una población mexicana (25).
Puntajes SF-6. El formato corto-6D es una medida basada en una clasificación del estado de salud basado en preferencia, desarrollada del SF-36. Todos los participantes que completan el SF-36 pueden obtener un puntaje SF-6D (26). El SF-6D es una variable continua, calificada en una escala de 0.29-1.0, con 1.00 indicando salud óptima. Ha sido utilizada en evaluaciones económicas de intervenciones para EREA (27).
Análisis de Datos
Las variables continuas se reportan como medias y desviaciones estandard y las variables categóricas mediante porcentajes. Se utilizó la prueba de chi cuadrada para evaluar la asociación de las características demográficas con la modalidad de diálisis. Las comparaciones entre los puntajes de CVRS y los grupos de tratamiento se realizaron mediante análisis de varianza (ANOVA). Los tamaños del efecto se estimaron utilizando la d de Cohen. Se realizó un análisis de regresión linear controlando los factores sociodemográficos, los ingresos (ESE), y los trastornos del sueño. Para el análisis de los datos se utilizó SAS (V9.1) y el SPSS (V25). Se consideró una P <0.05 como estadísticamente significativo excepto cuando se señale.
Se realizó un análisis de costo-efectividad utilizando el método de año de vida ajustado a la calidad (QALY) para examinar el costo-efectividad de cada grupo de modalidad de diálisis. Los datos de los costos se obtuvieron de la información disponible en línea de fuentes gubernamentales mexicanas. Se calculó el QALY como el número de años en diálisis/hemodiálisis X el puntaje SF6D. La tasa de la diferencia en el costo sobre la diferencia en efectividad (QALY) se calculó para cada una de las tres terapias con lo que se obtuvo la tasa de incremento de costo-efectividad (ICER).
Resultados
De los 125 pacientes que fueron invitados a participar, solo 121 cubrieron los criterios de inclusión, y todos acordaron participar voluntariamente y firmar el consentimiento informado. Las características sociodemográficas y clínicas de los pacientes que consintieron participar se muestran en la Tabla 1.
Tabla 1. Características Sociodemográficas y Clínicas de los Participantes del Estudio por Modalidad de Diálisis.
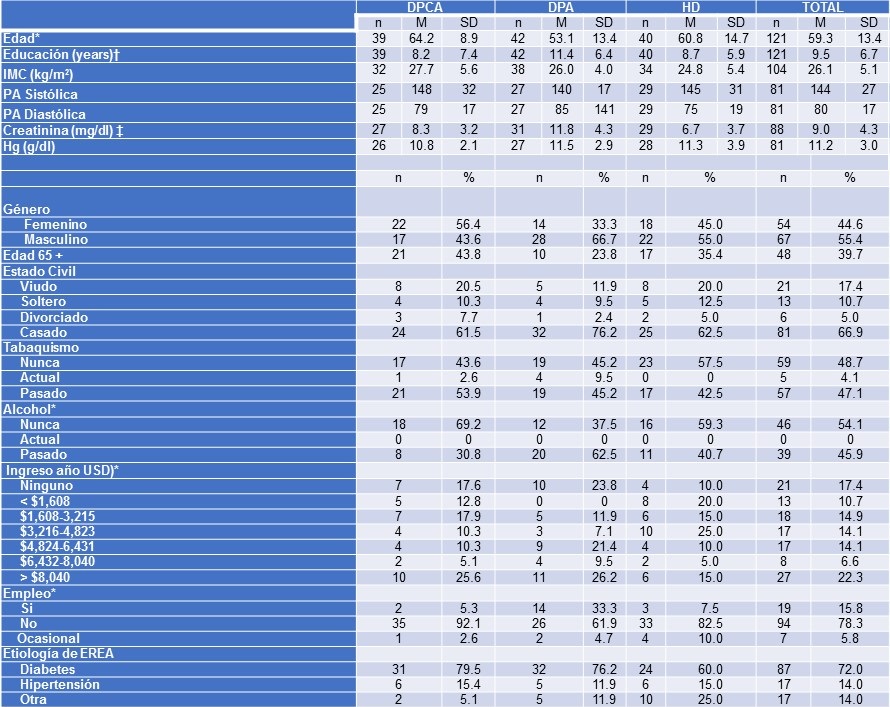
Nota: ‡p<0.01; *p < 0.05; †p<0.10
DPA (Diálisis Peritoneal Automatizada); DPCA (Diálisis Peritoneal Continua Ambulatoria); HD (Hemodiálisis).
Hubo un porcentaje ligeramente mayor de hombres (55.4%) y el 39.7% tenían 65 años o más de edad. Las características clínicas no estuvieron disponibles para todos los pacientes. Sin embargo, los pacientes dializados con DPA fueron más jóvenes, con más años de educación, tenían mayores ingresos, consumían menos alcohol y era más común que estuvieran laborando. Hubo una tendencia de los pacientes de DPA a tener un mayor nivel de creatinina sérica. Aparte de lo anterior, no hubo más diferencias entre los grupos.
La prevalencia de trastornos y síntomas de sueño auto-reportada en total, así como su clasificación por modalidad de diálisis se presenta en la Tabla 2.
Tabla 2. Prevalencia de Trastornos y Síntomas del Sueño Auto-reportados por Tipo de Diálisis
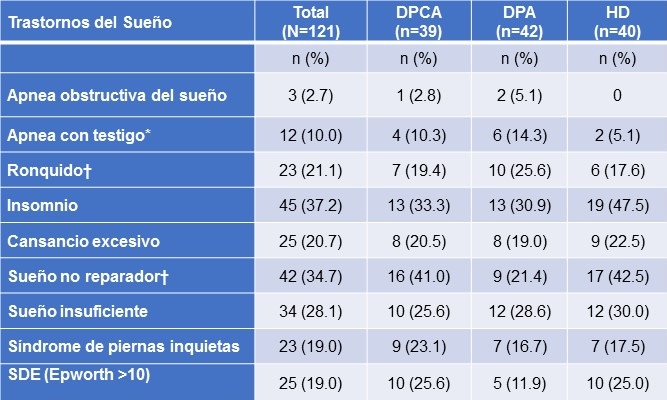
Nota: *p < 0.05, †p <0.10
SDE (Somnolencia diurna excesiva); DPA (Diálisis Peritoneal Automatizada); DPCA (Diálisis Peritoneal Continua Ambulatoria); HD (Hemodiálisis).
Notablemente, todos los pacientes reportaron por lo menos un síntoma de sueño en el año anterior (datos no mostrados). El insomnio fue el trastorno reportado con mayor frecuencia y particularmente con mayor prevalencia en pacientes de HD, aunque este resultado no fue estadísticamente significativo. También se observó una tendencia de reportar mayores tasas de sueño no reparador en los pacientes de HD (42.5%) y DPCA (41.0%) comparados con los pacientes de DPA (19.0%). En contraste, los pacientes de DPA reportaron mayores tasas de apnea observada por otros y ronquido (14.3% y 25.6%, respectivamente) comparados con los pacientes en DPCA (10.3%, 19.4%) y HD (5.1%, 17.5%). Los pacientes en DPA reportaron con menor frecuencia SSD (11.9%) en la ESE pero esta diferencia no fue significativa al compararla con DPCA (25.6%) y HD (25.0%). La prevalencia de trastornos del sueño fue igual en los pacientes menores de 65 años al compararlos con los mayores de 65 años (datos no mostrados) excepto para el aspecto de despertarse muy temprano y no poder volver a quedarse dormidos (menores: 32.9% vs. mayores: 51.2%, p=0.05).
La Tabla 3 presenta la comparación de los ocho dominios del SF-36 y los puntajes del Resumen del Componente Físico y Mental (RCF y RCM) para los tres grupos de diálisis con tamaños de efecto para comparaciones pares.
Tabla 3. Puntajes Promedio y Desviaciones Estándar para los Dominios de SF-36, Puntajes de los Componentes Físico y Mental y Puntajes de SF-6D por Modalidad de Diálisis
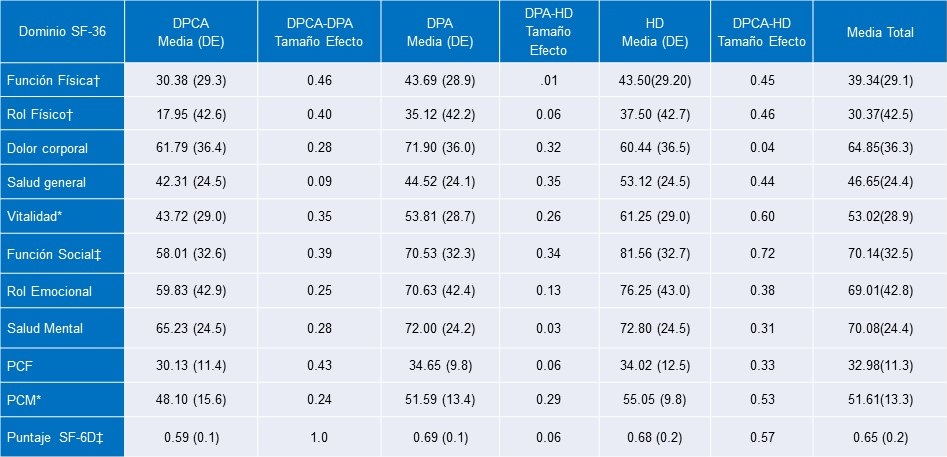
Nota: ‡p<0.01; *p < 0.05; †p <0.10
PCF (Puntaje Componente Físico); PCM (Puntaje Componente Mental); DE (Desviación Estándar); DPA (Diálisis Peritoneal Automatizada); DPCA (Diálisis Peritoneal Continua Ambulatoria); HD (Hemodiálisis).
Los tamaños de efecto de Cohen d fueron calculados examinando las diferencias entre grupos de tipo de diálisis (tamaño de efecto pequeño ~0.2, tamaño de efecto mediano ~0.5, tamaño de efecto grande ~0.8)
Los pacientes en HD reportaron significativamente mejor CVRS para Vitalidad y una tendencia hacia una mayor Función Social comparado con las personas en DPCA y DPA; los pacientes en DPCA experimentaron una calidad de vida más pobre en estas dos escalas. Se observó una tendencia a indicar una mejor Función Física y Rol Físico de CVRS en los pacientes de DPA y HD en comparación con los pacientes de DPCA. Así mismo una tendencia a una mejor salud mental en el RCM para los que reciben HD y DPA comparado con los pacientes en DPCA. De manera Importante, los tamaños de efecto de varios dominios y subdominios mostraron ser generalmente pequeños a moderados para los contrastes entre DPCA y ya sea DPA o HD. De cualquier manera, las diferencias fueron pequeñas y poco importantes entre DPA y HD. No se observaron otras diferencias importantes entre los grupos en el SF-36.
Posteriormente, se investigaron los determinantes de la CVRS utilizando modelos multivariados con los factores sociodemográficos, comorbilidades, trastornos y síntomas de sueño auto reportados como posibles variables explicativas. La modalidad de diálisis (DPCA asociada con peor CVRS en comparación con HD y DPA, F=4.87, p<0.02), los trastornos y síntomas del sueño como grupo (p. e., cualquier síntoma relacionado con apnea obstructiva del sueño, insomnio, sueño insuficiente y síndrome de piernas inquietas, F=17.79, p<0.0001) y el ingreso económico (F=4.48, p<0.04) están asociados significativamente con peor CVRS en el RCM del SF-36, representando el 34% de la varianza (F=4.02, p<0.0004). En contraste, el modelo para el RCF no fue estadísticamente significativo. La CVRS fue significativamente mejor tanto para DPA (LSMedia=52.0+ 2.3) y HD (51.4 + 2.6) en comparación con DPCA (43.0 + 2.5, p<.025 vs. DPA/HD) en el modelo del Resumen del Componente Mental, pero no en el modelo de Resumen del Componente Físico (LSMedia: DPCA: 31.4 + 2.5, DPA: 33.7 + 2.3, HD: 34.8 + 2.5; p>0.05 para todas las comparaciones).
El análisis de costo-efectividad para cada modalidad de diálisis está en la Tabla 4.
Tabla 4. Análisis de Costos por Modalidad de Diálisis
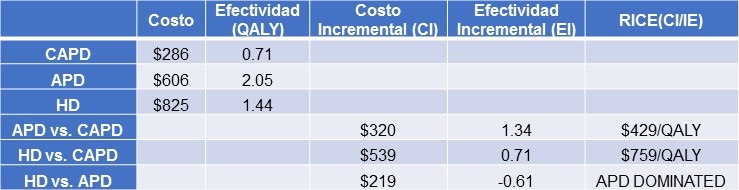
Nota: DPA (Diálisis Peritoneal Automatizada; DPCA (Diálisis Peritoneal Continua Ambulatoria); HD (Hemodiálisis). QALY (Años de Vida Aujstados a Calidad), RICE (Tasa Incremental de Costo Efectividad); EI(Efectividad Incremental); CI (Costo Incremental).
Aunque la DPCA fue la menos costosa, fue la menos efectiva (QALY=0.71); la DPA fue menos costosa que la HD, pero fue más efectiva (DPA QALY: 2.05 vs. HD QALY: 1.44) y la HD fue la más costosa con moderada efectividad. Comparando las tasas de incremento de costo efectividad entre DPA, DPCA y HD, la DPA fue superior a ambos DPCA y HD, y la HD mejor que la DPCA.
Discusión
En este estudio, encontramos que existe una alta prevalencia de trastornos y síntomas del sueño entre la población mexicana de pacientes con EREA, con diferencias en las prevalencias según la modalidad de diálisis. Como en otras condiciones médicas crónicas, la CVRS, particularmente en los aspectos de salud mental, fue pobre en estos pacientes y de manera notable, la presencia de trastornos del sueño fue un determinante importante para una peor CVRS.
Consistentemente con previos reportes (12,13,28) observamos que los trastornos del sueño y sus síntomas son comunes entre pacientes mexicanos en diálisis. La explicación de la alta frecuencia de trastornos del sueño y sus síntomas en EREA es multifactorial incluyendo cuestiones metabólicas, medicamentos, pobre higiene de sueño y disfunción en el control ventilatorio (13). Además, encontramos que existen diferentes porcentajes de prevalencia para algunos trastornos del sueño y sus síntomas según las modalidades de diálisis. Las investigaciones previas que comparan la prevalencia de los trastornos del sueño entre modalidades de diálisis no han sido consistentes. Algunos estudios que comparan solo la DPA con la DPCA no encontraron diferencias (15-17). En otros, los problemas del sueño como un síntoma general tienden a ser más comunes en la DPA comparada con la DPCA (18), y más frecuentemente en HD en comparación con DP (19). En nuestro conocimiento, sólo existe un estudio que compara las frecuencias de trastornos del sueño y sus síntomas entre las tres modalidades de diálisis (20). En ese estudio, la frecuencia de insomnio fue alta (<80%), pero no diferente entre las modalidades de diálisis. La apnea obstructiva del sueño fue la menos común entre los pacientes de HD (36% vs. 60%[DPA] y 65% [DPCA]). Además, ellos observaron menos SPI en pacientes de HD (23%) en comparación con la DPA (50%) y la DPCA (33%). En contraste, nosotros observamos que el sueño no reparador, un síntoma del insomnio, fue más común en HD y DPCA, el ronquido y las apneas observadas por otros fueron más frecuentes en DPA, y no hubo diferencias en las tasas de prevalencia de SPI. La explicación de estas grandes discrepancias entre los estudios no es clara. Sin embargo, las posibilidades incluyen diferencias en las características sociodemográficas de las poblaciones de estudio y las preguntas utilizadas para recolectar la información. Se requieren estudios futuros, particularmente aquéllos que utilicen polisomnografía nocturna y cuestionarios estandarizados.
Encontramos que hubo pocas diferencias en la prevalencia de los trastornos del sueño y sus síntomas entre pacientes jóvenes y viejos con EREA. La única excepción fue el despertar muy temprano, que es una queja común en los ancianos y puede reflejar una fase avanzada de alteración del horario del sueño (29). Por otro lado, en contraste con nuestros hallazgos, las personas mayores de las cohortes de población general reportan más problemas con su sueño (30, 31). Proponemos que el impacto negativo de la EREA sobre la calidad del sueño tiene un mayor impacto entre los pacientes jóvenes, evitando así las diferencias por edad en las tasas de prevalencia.
A pesar de la disponibilidad de la diálisis para tratar la EREA, la CVRS se mantiene baja comparada con la población general (3,4). Nuestros hallazgos en una cohorte de pacientes con EREA mexicanos tratados con tres diferentes modalidades de diálisis no difieren y generalmente son consistentes con los datos de un estudio grande de pacientes con EREA de EUA (32). Sin embargo, comparado con un estudio previo de pacientes con EREA mexicanos, todos ellos recibiendo HD (28), encontramos menores puntajes en la Función Física y mayores puntajes en las escalas de Rol Emocional. En el presente estudio una tercera parte de los participantes corresponde a pacientes en DPCA, por lo que nuestro hallazgo de una peor Función Física puede atribuirse a los bajos puntajes de este subgrupo. La discrepancia en la escala de Rol Emocional, sin embargo, se mantiene sin explicación. Las comparaciones internacionales en CVRS en pacientes con EREA muestran una heterogeneidad considerable (32). Esto puede estar relacionado a la diversidad cultural, a los determinantes sociales de la salud, a las inequidades en salud o a las diferencias en el sistema de atención de la salud entre los países. En México, la disponibilidad y la adecuación de la diálisis varía considerablemente dependiendo de la seguridad social del paciente (2). Independientemente de las potenciales diferencias interculturales internacionales, es importante para los clínicos y los trabajadores de la salud saber que la CVRS está reducida en la EREA y que es comparable a otras condiciones crónicas médicas a pesar del uso de la diálisis. Nuestros resultados apoyan la recomendación de Jha y colaboradores de que los programas nacionales para las enfermedades crónicas deben incluir estrategias para reducir la carga y los costos relacionados a la enfermedad renal (33).
Es importante mencionar que en el análisis de multivariado encontramos la presencia de trastornos del sueño como el principal factor que afecta de manera adversa la CVRS, principalmente en el componente de salud mental de la CVRS. Otros estudios también han encontrado asociaciones negativas entre varios trastornos del sueño y la CVRS de los pacientes con EREA (12, 14). Nuestros resultados, sin embargo, amplían estas observaciones previas hacia la población latinoamericana. Éstos resaltan la importancia del sueño como un determinante de la CVRS en EREA y sugieren que la búsqueda de pobre calidad del sueño y los trastornos del sueño debería ser parte esencial del cuidado de los pacientes que se están tratando con diálisis crónica. Así mismo, deben desarrollarse estrategias para la promoción de la salud del sueño y ser implementadas en relación con esta población para evaluar la mejoría de la CVRS, de esta manera reduciendo los costos de salud, las secuelas por la EREA y el tipo de diálisis.
Además de los trastornos del sueño, observamos que la modalidad de diálisis fue un determinante importante en la CVRS. Existen varios estudios que han examinado el tipo de modalidad de diálisis con la CVRS y la mayoría reporta mejor CVRS en pacientes en DP comparados con HD como tratamiento para la EREA (5, 6). Un estudio en pacientes ancianos, sin embargo, no observó diferencias entre PD y HD (7). Se sugiere que las restricciones dietéticas y de viajes son menores, y que las oportunidades de recreación y de acceso a la diálisis se mejoran con la DP resultando un una mejor CVRS (34). Adicionalmente, los índices de depresión pueden ser mayores comparando la HD con la DP (5). Existen menos estudios que comparan la DPA con la DPCA (3, 16, 18, 35) y la mayoría muestra que la DPA está asociada con una mejor CVRS (3, 18, 35). El aporte de nuestro estudio es que es uno de los pocos en examinar la calidad de vida en las tres modalidades de diálisis simultáneamente (36). Nuestros resultados sugieren que en comparación con la HD y la DPA, la DPCA está asociada con una peor CVRS con tamaños de efecto pequeños a moderados; hubo poca diferencia entre la HD y la DPA con tamaños de efecto de ligeros a pequeños. La carga requerida para realizar continuos cambios de soluciones en la DPCA comparado con los intercambios automáticos por la noche en la DPA o con visitas programadas a los centros de diálisis para la HD, probablemente explica este hallazgo. Además, nuestro análisis de costo-efectividad indica que para el panorama socioeconómico de México, la DPA debería ser la modalidad preferida de diálisis.
Nuestro estudio tiene limitaciones importantes. Primero, la población de estudio no fue seleccionada prospectivamente o aleatorizada respecto a la modalidad de diálisis. Desafortunadamente, la elección de una modalidad de diálisis en México y en otros lados, depende del tipo de seguridad social, el ingreso económico del paciente o la disponibilidad de los recursos. De esta manera, es posible que nuestros hallazgos relacionados con la CVRS y los trastornos del sueño hayan sido impactados por un sesgo en la asignación. Por ejemplo, la DPCA puede haber sido proporcionada a los pacientes con menores ingresos, de manera que eso afecta en una peor CVRS. Intentamos mitigar esto controlando algunas de las variables de sesgo potencial con un análisis multivariado. De cualquier manera, puede estar presente alguna confusión residual. Segundo, nuestro análisis es transversal y no puede confirmarse la causalidad. Tercero, la presencia de trastornos del sueño y sus síntomas fue auto-reportada; puede haber existido error en la clasificación. Si hubo error de clasificación, sin embargo, ésta probablemente no hizo diferencias. Por último, nuestra muestra de estudio es relativamente pequeña; algunas diferencias no estadísticamente significativas pueden representar un error tipo II. De manera contraria, el uso de comparaciones múltiples puede haber resultado en un error tipo I en algunos casos.
En resumen, la CVRS está reducida en los pacientes con EREA mexicanos y la presencia de trastornos del sueño puede ser un importante conductor para este hallazgo. Las intervenciones dirigidas a mejorar la calidad del sueño y el tratamiento de los trastornos del sueño pueden mejorar la CVRS en esta población. Las diferencias en la CVRS entre las modalidades de diálisis sugieren que en México, la DPA debería ser la modalidad de diálisis de preferencia.
Reconocimientos
El financiamiento de apoyo fue proporcionado a la Dra. Luxana Reynaga-Ornelas por la beca Bardewick de Arizona State University y la beca PROMEP de la Universidad de Guanajuato. El Dr. Quan fue parcialmente apoyado por AG009975 del National Institute of Aging. Reconocemos con agradecimiento la participación en la revisión del texto en Español y la traducción inversa a la Dra. Ma. Guadalupe Reynaga-Ornelas, Nutrióloga y Doctora en Ciencias Médicas, profesora investigadora del Departamento de Medicina y Nutrición de la División de Ciencias de la Salud del Campus León de la Universidad de Guanajuato.
Referencias
- Liyanage T, Ninomiya T, Jha V, et al. Worldwide access to treatment for end-stage kidney disease: a systematic review. Lancet. 2015;385(9981):1975-82. [CrossRef] [PubMed]
- García-García G, García-Bejarano H, Breien-Coronado H, et al. Chapter 9 - End-Stage Renal Disease in Mexico. In: Chronic Kidney Disease in Disadvantaged Populations. García-García G, Agodoa LY and Norris K, eds. Cambridge, MA: Academic Press, 2017; 77-83. [CrossRef] [PubMed]
- Reina Neyra M, Cirera Segura F, Martín Espejo J. Salud Percibida por los Pacientes en DPCA y DPA. Rev Soc Esp Enferm Nefrol. 2008;11(2):26-33. [CrossRef]
- Guerini Rocco D, Mercieri A, Yavuzer G. Multidimensional health-status assessment of chronic hemodialysis patients: the impact on quality of life. Eura Medicophys. 2006;42(2):113-9. [PubMed]
- Ginieri-Coccossis M, Theofilou P, Synodinou C, Tomaras V, Soldatos C. Quality of life, mental health and health beliefs in haemodialysis and peritoneal dialysis patients: investigating differences in early and later years of current treatment. BMC Nephrol. 2008;914-2369-9-14. [CrossRef] [PubMed]
- Chen JY, Wan EYF, Choi EPH, et al. The health-related quality of life of chinese patients on hemodialysis and peritoneal dialysis. Patient. 2017;10(6):799-808. [CrossRef] [PubMed]
- Harris SA, Lamping DL, Brown EA, Constantinovici N, North Thames Dialysis Study (NTDS) Group. Clinical outcomes and quality of life in elderly patients on peritoneal dialysis versus hemodialysis. Perit Dial Int. 2002;22(4):463-70. [PubMed]
- Queeley GL, Campbell ES. Comparing treatment modalities for end-stage renal disease: A meta-analysis. Am Health Drug Benefits. 2018;11(3):118-27. [PubMed]
- Manavalan M, Majumdar A, Harichandra Kumar KT, Priyamvada PS. Assessment of health-related quality of life and its determinants in patients with chronic kidney disease. Indian J Nephrol. 2017;27(1):37-43. [CrossRef] [PubMed]
- Wyld M, Morton RL, Hayen A, Howard K, Webster AC. A systematic review and meta-analysis of utility-based quality of life in chronic kidney disease treatments. PLoS Med. 2012;9(9):e1001307. [CrossRef] [PubMed]
- Yang F, Luo N, Lau T, Yu ZL, Foo MWY, Griva K. Health-related quality of life in patients treated with continuous ambulatory peritoneal dialysis and automated peritoneal dialysis in Singapore. Pharmacoecon Open. 2018;2(2):203-8. [CrossRef] [PubMed]
- Brekke FB, Amro A, Hortemo Osthus TB, Dammen T, Waldum B, Os I. Sleep complaints, depression and quality of life in Norwegian dialysis patients. Clin Nephrol. 2013;80(2):88-97. [CrossRef] [PubMed]
- Hanly P. Sleep disorders and end-stage renal disease. Curr Opin Pulm Med. 2008;14(6):543-50. [CrossRef] [PubMed]
- Edalat-Nejad M, Qlich-Khani M. Quality of life and sleep in hemodialysis patients. Saudi J Kidney Dis Transpl. 2013;24(3):514-8. [CrossRef] [PubMed]
- Turkmen K, Yazici R, Solak Y, et al. Health-related quality of life, sleep quality, and depression in peritoneal dialysis and hemodialysis patients. Hemodial Int. 2012;16(2):198-206. [CrossRef] [PubMed]
- Guney I, Solak Y, Atalay H, et al. Comparison of effects of automated peritoneal dialysis and continuous ambulatory peritoneal dialysis on health-related quality of life, sleep quality, and depression. Hemodial Int. 2010;14(4):515-22. [CrossRef] [PubMed]
- Eryavuz N, Yuksel S, Acarturk G, et al. Comparison of sleep quality between hemodialysis and peritoneal dialysis patients. Int Urol Nephrol. 2008;40(3):785-91. [CrossRef] [PubMed]
- Bro S, Bjorner JB, Tofte-Jensen P, et al. A prospective, randomized multicenter study comparing APD and CAPD treatment. Perit Dial Int. 1999;19(6):526-33. [PubMed]
- Eghbali M, Shahqolian N, Nazari F, Babaee S. Comparing problems of patients with chronic renal failure undergoing hemodialysis and peritoneal dialysis referring to medical university's hospitals. Iran J Nurs Midwifery Res. 2009;14(1):1-5.
- Losso RL, Minhoto GR, Riella MC. Sleep disorders in patients with end-stage renal disease undergoing dialysis: comparison between hemodialysis, continuous ambulatory peritoneal dialysis and automated peritoneal dialysis. Int Urol Nephrol. 2015;47(2):369-75. [CrossRef] [PubMed]
- Baldwin CM, Choi M, McClain DB, Celaya A, Quan SF. Spanish translation and cross-language validation of a sleep habits questionnaire for use in clinical and research settings. J Clin Sleep Med. 2012;8(2):137-46. [CrossRef] [PubMed]
- Johns MW. A new method for measuring daytime sleepiness: the Epworth sleepiness scale. Sleep. 1991;14(6):540-5. [CrossRef] [PubMed]
- Ferrer M, Vilagut G, Monasterio C, Montserrat JM, Mayos M, Alonso J. Measurement of the perceived impact of sleep problems: the Spanish version of the functional outcomes sleep questionnaire and the Epworth sleepiness scale. Med Clin (Barc). 1999;113(7):250-5. [PubMed]
- Ware JE,Jr, Sherbourne CD. The MOS 36-item short-form health survey (SF-36). I. Conceptual framework and item selection. Med Care. 1992;30(6):473-83. [CrossRef] [PubMed]
- Zúniga AM, Carrillo-Jiménez TG, Fos JP, Gandek B, Medina-Moreno M. Evaluación del estado de salud con la Encuesta SF-36: resultados preliminares en México. Salud Pública de México. 1999;41(2):110-8. [CrossRef] [PubMed]
- Brazier J, Roberts J, Deverill M. The estimation of a preference-based measure of health from the SF-36. J Health Econ. 2002;21(2):271-92. [CrossRef]
- Davison SN, Jhangri GS, Feeny DH. Comparing the health utilities index mark 3 (HUI3) with the short form-36 preference-based SF-6D in chronic kidney disease. Value Health. 2009;12(2):340-5. [CrossRef] [PubMed]
- Dehesa-Lopez E, Correa-Rotter R, Olvera-Castillo D, Gonzalez-Parra C, Baizabal-Olarte R. Clinical, dialytic, and laboratory factors associated with poor health-related quality of life in Mexican patients on hemodialysis. Rev Invest Clin. 2016;68(4):192-200. [PubMed]
- Kim JH, Duffy JF. Circadian rhythm sleep-wake disorders in older adults. Sleep Med Clin. 2018;13(1):39-50. [CrossRef] [PubMed]
- Klink M, Quan SF. Prevalence of reported sleep disturbances in a general adult population and their relationship to obstructive airways diseases. Chest. 1987;91(4):540-6. [CrossRef] [PubMed]
- Ohayon MM, Zulley J, Guilleminault C, Smirne S, Priest RG. How age and daytime activities are related to insomnia in the general population: consequences for older people. J Am Geriatr Soc. 2001;49(4):360-6. [CrossRef] [PubMed]
- Fukuhara S, Lopes AA, Bragg-Gresham JL, et al. Health-related quality of life among dialysis patients on three continents: the Dialysis Outcomes and Practice Patterns Study. Kidney Int. 2003;64(5):1903-10. [CrossRef] [PubMed]
- Jha V, Garcia-Garcia G, Iseki K, et al. Chronic kidney disease: global dimension and perspectives. Lancet. 2013;382(9888):260-72. [CrossRef] [PubMed]
- Wu AW, Fink NE, Marsh-Manzi JV, et al. Changes in quality of life during hemodialysis and peritoneal dialysis treatment: generic and disease specific measures. J Am Soc Nephrol. 2004;15(3):743-53. [CrossRef] [PubMed]
- de Wit GA, Merkus MP, Krediet RT, de Charro FT. A comparison of quality of life of patients on automated and continuous ambulatory peritoneal dialysis. Perit Dial Int . 2001;21(3):306-12. [PubMed]
- Caballero-Morales S, Trujillo-Garcia JU, Welsh-Orozco U, Hernandez-Cruz ST, Martinez-Torres J. Calidad de vida en pacientes con hemodiálisis, diálisis peritoneal continua ambulatoria y automatizada. Arch Med Fam. 2006;8(3):163-8.
Cite as: Reynaga-Ornelas L, Baldwin CM, Arcoleo K, Quan SF. Impacto del sueño y la modalidad de diálisis sobre la calidad de vida en una población. Southwest J Pulm Crit Care. 2020;20(3):105-18. doi: https://doi.org/10.13175/swjpcc019-20 PDF

Reader Comments